|
|
NISINA
AD ALTA POTENZA , LFE
(LFE-15000, LFE-8000, LFE-1000)
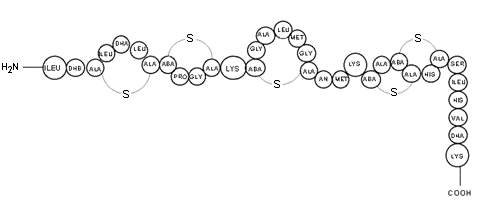
ABA=
acido amino butirrico
DHA=
deidroalanina
Ala-S-Ala=
lantionina
DHB=
deidroabutirina
Aba-S-Ala=
B metilantionina
Generalità
|
La
Nisina è un batteriocina peptidica policationica
prodotta dalla fermentazione di Lactococcus lactis
che
agisce su specie batteriche GRAM+ ma anche su GRAM-
con opportune associazioni.
|
|
Categoria
|
Biopreservante
per alimenti e cosmetici.
|
|
Meccanismo
d’azione
|
Agisce
interferendo con la parete cellulare o le membrane dei
microrganismi bersaglio. Inibizione della biosintesi della parete
cellulare, e/o formazione di pori nella parete cellulare. Legame a
strutture di membrana (Lipide II) che controllano la sintesi della
parete cellulare batterica.
|
|
Spettro
d’azione
|
Attivo
nei confronti di :
-
Lysteria
monocytogenes
-
Staphylococcus
aureus Meticillino
resistenti
-
Enterococci
Vancomicina
resistenti
-
Spore
di Bacillus e Clostridium
-
Bacillus
Subtilis.
-
Bacillus
Cereus
-
Lactobacillus
fructivorans
-
Salmonella
Typhimurium (in
associazione con EDTA)
|
|
Campi
di applicazione
|
Come
conservante per uso alimentare (tofu, succhi di frutta, carne,
sughi, birra, pomodoro, pasta, pesce, latte). Uso cosmetico, INCI/CTFA:
LACTOCOCCUS
FERMENT.
Uso veterinario (per trattamento mastite)
|
|
Restrizione
di utilizzo
|
|
|
Potenziamento
attività
|
-
CHELANTI:
Attivo contro i Gram negativi se usato in
associazione con EDTA
e esametafosfato di sodio (NaHMP)
-
OLI
ESSENZIALI:
sinergismo in associazione con oli essenziali (timolo,
carvacrolo) ed esteri del saccarosio
-
Calore
-
Atmosfera
protettiva
|
|
Concentrazioni
d’uso
|
LFE
–15000 : 50-100 ppm (prodotti speciali)
LFE-8000
: 0,01-0,02 % (uso cosmetico)
LFE-1000
: 0.1-0.5 %(conservazione alimentare)
|
Tossicità e
sicurezza d’impiego
|
|
Campi di
applicazione alimentare
|
-
Coating alimentare contro Salmonella (attivo contro Gram
negativi in associazione con EDTA).
-
Coating su carne bianca contro Listeria monocytogenes (in
associazione con acido Laurico). Associazione con esteri della
cellulosa e acidi grassi con per Listeria monocytogenes
e Staphylococcus aureus.
- In associazione con acido lattico per la conservazione
della carne
- Nisina
associata a
calore battericida
per E. Coli (Gram-).
|
Altre proprietà
|
Stabilizzante
ed emulsionante per uso alimentare, farmaceutico e cosmetico
|
GENERALITA’
Negli ultimi anni si è assistito ad un crescente sforzo finalizzato
alla ricerca di nuovi prodotti deputati alla protezione gli alimenti
dalla contaminazione microbica. Attualmente esiste una grande
varietà di prodotti chimici che si utilizzano nell’industria per la
conservazione degli alimenti,[i]
ma nonostante la conservazione con sostanze chimiche di sintesi fornisca
molti vantaggi, i consumatori sono sempre più attenti agli eventuali
effetti tossici. Per queste ragioni, i produttori si indirizzano sempre
più, verso la ricerca di sostanze additive alternative, possibilmente
di origine naturale, per ridurre o evitare i conservanti chimici
tradizionali. Anche se l’ingrediente di origine naturale è
generalmente meglio accettato, perché ritenuto binomio di innocuità e
sicurezza, tuttavia non è però semplice coniugare, l’origine e la
sicurezza, con l’efficacia ed applicabilità nella industrializzazione
dei processi di produzione[ii].
I sorbati, ad esempio, sono usati normalmente per combattere funghi e
lieviti ma non sono battericidi, e per ampliare lo spettro di attività
devono essere associati ad altre sostanze. Come è noto, gli antibiotici
vengono prodotti dai microrganismi, batteri, muffe, ecc.., allo scopo di
contrastare lo sviluppo di altri microrganismi loro competitori. A
questo proposito, un’interessante classe di sostanze é rappresentata
dalle batteriocine, piccole proteine con spiccate capacità
antimicrobiche prodotte da determinate ceppi di batteri[iii],[iv],[v].
L’impiego di batteriocine come biopreservanti è stata ampliamente
valutato, e si é dimostrato una strategia efficace nel controlllo dei
microorganismi patogenici.[vi]
A questo gruppo appartiene la
Nisina, un lantibiotico, costituito da peptidi antimicrobici,
caratterizzati dalla presenza dell’amminoacido lantionina, derivante
da modificazioni posttraduzionali. La Nisina è una batteriocina
prodotta dal ceppo Lactococcus Lactis (microrganismo probiotico)
o da Streptococcus Lactis [vii].
Isolata nel 1928, è stata introdotta come antimicrobico in alcuni
alimenti negli anni ’50 e da allora si utilizza per il controllo del
deterioramento batterico degli alimenti termoelaborati che si conservano
a pH acido. E’ un agente antimicrobico efficace contro un’ampia
gamma di batteri Gram +, cellule vegetative e spore.
MECCANISMO
D’AZIONE : La Nisina è
un peptide amfifilico e idrofilo e sono almeno due i meccanismi
d’azione ipotizzati 2: nel primo caso
si ipotizza che, similmente ai macrolidi polienici, le batteriocine
formino nella parete batterica un “poro” nel quale i monomeri delle
medesime si uniscono e polimerizzavano con effetto sulla pressione
osmotica cellulare. Nel secondo caso si ipotizza che le batteriocine
destabilizzino la membrana agendo da tensioattivi[viii]. Nel primo meccanismo si spiega l’influenza del pH
sull’azione della Nisina in quanto il legame Nisina-batteri avviene
per interazione elettrostatica con la carica negativa dei fosfolipidi di
membrana, seguita da un
ri-orientazione che dipende dal potenziale di membrana del microrganismo
2. Studi con marcatori fluorescenti hanno dimostrato come il
grado di interazione della Nisina con il bilayer lipidico dipenda dalla
concentrazione della stessa batteriocina. Il grado di tale binding
determina l’efflusso di ATP intracellulare che porta a morte
cellulare. Si è potuto inoltre riscontrare che, a pH neutro, si hanno
meno molecole di Nisina legate sulla superficie[ix],[x].
Recenti studi hanno rivisto però il meccanismo della formazione del
poro, che non sembra descrivere adeguatamente il meccanismo delle
batteriocine: è stato osservato il binding della Nisina con il lipide
II di membrana che controlla la sintesi della parete cellulare [xi].
STABILITA’
E CONDIZIONI DI UTILIZZO:
La stabilità della molecola, la solubilità e la relativa attività
antibatterica sono pH dipendenti, esse diminuiscono all’aumentare del
pH. La Nisina ha un punto isoelettrico nel range alcalino, quindi la
carica netta sulla superficie della molecola dovrebbe essere più alta a
valori di pH acidi che neutri. Il massimo di adsorbimento della Nisina
sulle cellule batteriche è stato osservato a pH 6.5, e meno della metà
è assorbito a pH 4.4. Queste considerazioni confermano che la Nisina
presenta l’attività antimicrobica più alta a pH acido. Infatti in
condizioni basiche l’attività si perde rapidamente a causa della
vicinanza al punto isoelettrico della proteina (30’, 63°C a pH 11) e
questo può rappresentare un limite alle sue possibilità formulative.
Per quanto riguarda la termostabilità della Nisina, le soluzioni al 2%
sono stabili entro range di temperature che vanno da 2 a 121°C senza
perdita di attività. La quantità di Nisina normalmente utilizzata
nella conservazione degli alimenti è totalmente solubile in acqua, ma
insolubile nei solventi non polari. Si utilizzano normalmente da 50 a
100 g per tonnellata di prodotto[xii].
TIPOLOGIA
DI ALIMENTI CONSERVABILI Studi
recenti hanno dimostrato la capacità conservante della Nisina su
un’ampia gamma di prodotti alimentari tra i quali : condimenti a pH
acido 1,2 (maionese, ketch-up, salse) e prodotti come succhi
di frutta e sughi. E’ stata utilizzata per la conservazione del tofu,
latte fermentato, ricotta e yogurt [xiii],
carne [xiv]
e soprattutto in oriente per il pesce (salmone affumicato e altre
tipologie ittiche associandola ad atmosfera controllata) [xv]
e purè di patate, dove è indicata rispetto ad altri conservanti vista
la resistenza alla pastorizzazione [xvi].
SPETTRO
ANTIMICROBICO: La
Nisina è risultata efficace come conservante del deterioramento
microbico dato da microrganismi quali la Listeria monocytogenes 14,16,
Lactobacillus fructivorans 2 un
microrganismo normalmente presente nelle salse e condimenti, dalle
spore di Bacillus Subtilis e Clostridium nella purea
di patate 17, Staphylococcus
aureus meticillino resistenti e Enterococci Vancomicina resistenti[xvii],
B. thermosphacta, Lactobacillus sakei, Leuconostoc mesenteroides.
L’azione sui Gram- (Salmonella Typhimurium)
si ottiene con l’associazione ad agenti in grado di
allargare il suo spettro come gli agenti sequestranti i metalli (EDTA)[xviii].
Si è dimostrata una delle più efficaci batteriocine nei confronti del Bacillus
cereus (Batterio
enterotossigeno) che è un noto contaminate dei prodotti
per l’infanzia.
TECNOLOGIA
DELLA CONSERVAZIONE CON NISINA:
Applicazioni particolari sono state effettuate nella filmatura, coating
per alimenti. Si è dimostrata attiva contro la Salmonella
Typhimurium per la
conservazione del pollo, rinforzata dall’uso di chelanti quali
l’EDTA (5 mM) e con concentrazioni di Nisina 100, 300 e 500 mg/ml (coating
con acido citrico 3%, 0.5% Tween 80
0.5% calcio arginato)15. In associazione con lisozima
è stata utilizzata in via sperimentale nel coating del prosciutto19.
Sono stati realizzati coating con Nisina e acido laurico valutandone
l’azione verso la specie microbica Listeria monocytogenes.19
I film con idrossimetilpropilcellulosa servono per ridurre l’umidità
che favorisce la crescita batterica. L’aggiunta di acidi grassi alla
Nisina ne migliora le proprietà antimicrobiche19. Ovviamente
tale prodotto non può essere utilizzato, in quanto “ostacolo” alla
crescita microbica, in tutti quei prodotti alimentari che necessitano di
elaborazione da parte di microrganismi:
maturazione del prosciutto, fermentazione del latte, ecc.
3
POTENZIAMENTO D’AZIONE : La Nisina è in grado di inattivare la flora microbica Gram+
in quanto capace di ridurne la permeabilità della membrana
citoplasmatica. Al contrario, i batteri Gram-, possedendo una
membrana esterna impermeabile alla Nisina, non ne vengono influenzati.
Pertanto, la Nisina, di per sé, non inibisce importanti patogeni quali Escherichia
coli, Salmonella spp., Campylobacter spp. e Yersinia
enterocolitica, mentre è letale per Bacillus spp., Clostridium
spp. e Listeria monocytogenes. Al fine di incrementarne
l’efficacia, sono state valutate associazioni con altre sostanze
naturali che hanno mostrato esplicare un'azione sinergica con la Nisina [xix].
Sono stati individuati i seguenti
effetti:
• Aumento dell’azione inibitoria della nisina nei confronti dei
batteri Gram+ in seguito a trattamenti combinati con oli
essenziali (carvacrolo, timolo e carvone estratti rispettivamente da
origano, timo e semi di cumino).
• Incremento dell’effetto della nisina e del carvone (estratto da
cumino e aneto) nei confronti di Listeria monocytogenes,
utilizzati in combinazione con lisozima.
• Aumento dell’effetto della nisina nei confronti dei batteri Gram+
in seguito all’addizione di esteri del saccarosio (emulsionanti).
• Aumento dell’azione della nisina utilizzata in combinazione con
una batteriocina simile alla pediocina
• Prolungamento della shelf life di carne di manzo e pesce fresco
mediante combinazione del trattamento con nisina con il confezionamento
in atmosfera protetta.
• Aumento dell’azione della nisina utilizzata in combinazione con
altri microrganismi protettivi in tofu e succhi di frutta
• Effetto sinergico di inattivazione di Bacillus cereus
derivante dall'impiego combinato di nisina e di trattamenti con campi
elettrici pulsati
• Permeabilizzazione della membrana esterna dei batteri Gram–
in associazione con EDTA e con esametafosfato di sodio (NaHMP)
SICUREZZA
DI IMPIEGO
La Nisina è stata valutata e approvata come conservante
alimentare per il controllo batterico (FAO/OMS 1969a), ed è
identificato con il numero E234. Attualmente la Nisina è inserita nella
categoria dei GRAS (Generally Recognized As Safe = generalmente
riconosciuto come sicuro) da parte della FDA (Food and Drug
Administration, USA)5,[xx],[xxi].
Solo alcuni tipi di batteriocine mostrano lieve tossicità, ma anche in
questi casi l’ingestione a lungo termine viene considerata priva di
conseguenze sulla salute 21.
USO
VETERINARIO
Mediante una formulazione particolare (AMBICIN N) è stata utilizzata
come germicida topico per la cura della mastite nelle mucche [xxii],[xxiii].
In questo studio, si è dimostrata efficace nell’inibire lo Staphylococcus
aureus e l’ Escherichia coli dopo appena 1 minuto dalla
applicazione. L’ azione battericida è risultata superiore ad una
soluzione al 0.1 %
di Iodofor (iodio complessato con
detergenti
idrosolubili e surfattanti) o 0.5 % di Clorexidina digluconato. Questa
formulazione ad uso topico mostra piccola o
nessuna
irritazione cutanea
dopo varie applicazioni mentre lo Iodofor
e
la Clorexidina
digluconato danno maggior grado
di
irritazione. E’ stato quindi approvato
dall’FDA23
nella cura della mastite delle mucche, anche perchè non influisce la
sicurezza del latte.
USO
COSMETICO:
Non esistono ad oggi applicazioni cosmetiche significative,
tranne che in prodotti per
l’igiene orale. Infatti, in uno studio si è dimostrata efficace nel
combattere gengivite e placca (in un veicolo al 1 mM di EDTA sodico, 100
e 300 mg/ml di Nisina) comparandola con una soluzione al 0.12 % di
clorexidina[xxiv].
Le sue proprietà unite alla grande sicurezza d’uso consentono però
di auspicarne l’impiego per la conservazione di varie forme
cosmetiche. L’unico limite è rappresentato dalla necessità di
operare a pH prevalentemente acidi. L’INCI name/CTFA suggerito per
questo prodotto è LACTOCOCCUS
FERMENT.
ALTRE
APPLICAZIONI. La Nisina
per le sue caratteristiche amfifiliche e proprietà adsorbenti,
unitamente alla non tossicità e attività antimicrobica si configura
come un candidato interessante per essere impiegato come emulsionante
per la preparazione di emulsioni
O/A, nell’industria alimentare, farmaceutica e cosmetica. Una
valutazione sperimentale delle capacità emulsionanti e stabilizzanti
della Nisina ha evidenziato una significativa capacità emulsionante, ma
che si presenta fortemente dipendente dal pH e dalla concentrazione.
|
Prodotto
|
Potenza
|
Uso
|
Dosaggio
|
|
LFE-15000
|
12000~15000
IU/mg
|
Prodotti
particolari
|
0,005-0,01
ppm
|
|
LFE-8000
|
8000~10000
IU/mg
|
Cosmetici
|
0,01-0,02
%
|
|
LFE-1000
|
1000
IU/mg
|
Derrate
alimentari
|
0.1-0.5‰
|
Questa scheda informativa è stata
redatta con la collaborazione scientifica di Stefano Manfredini,
Professore Ordinario di Chimica Farmaceutica, Università di Ferrara.
E’ vietata la riproduzione totale o parziale del testo e delle
immagini senza una dichiarazione scritta di POLICHIMICA.
Le informazioni contenute nella
seguente nota informativa sono allo stato attuale delle nostre
conoscenze accurate e corrette. Esse vengono tuttavia offerte senza
alcuna garanzia riguardo a possibili errori. In particolare non si
assumono responsabilità per ciò che attiene alla loro applicazione.
RIFERIMENTI
BIBLIOGRAFICI
[i]
Núñez,
G. A., Cayré, M. E., Castro, M. P.,
Campos, C.,
Garro, Oscar A. Actividad
de nisina sobre la microflora alterante de aderezos . Facultad de Agroindustrias -
Cdte.
Fernández 755 - (H3700LGO) Pcia. R. Sáenz Peña - Chaco -
Argentina.
[ii]
Meyer,
R.S., Grant M.A., Luedecke L.O., Leung H.K.. Effects
of pH and Water Activity on Microbiological Stability of Salad
Dressing. J. Food Protection, 52, 7, 477-479, 1989.
[iii]
a) Núñez,
G. A., Cayré, M. E., Castro, M. P.,
Campos, C.,
Garro, Oscar A.
Efectividad y modo de acción de nisina sobre Lactobacillus
fructivorans
- Cátedra Microbiología de Alimentos -
Facultad de Agroindustrias - UNNE. Comandante
Fernández 755 - (3700) Pcia. Roque Sáenz Peña - Chaco -
Argentina.Abee
T., Krockel L., Hill C. 1995.
b)
Bacteriocins: modes of action and potentials in food preservation
and control of food
poisoning.
Int. J. Food Microbiol. 28, 169-185
C)
Hechard
Y, Sahl HG. Mode
of action of modified and unmodified bacteriocins from Gram-positive
bacteria.
Biochimie 2002; 84(5-6):545-57
d) Perez
Guerra N, Pastrana Castro L.
Production of bacteriocins from Lactococcus lactis subsp. lactis
CECT 539 and Pediococcus acidilactici NRRL B-5627 using
mussel-processing waste.
Biotechnol Appl Biochem
36(Pt 2):119-25, 2002
[iv]
a)Estudios
bioquímicos y genéticos de bacteriocinas producidas por bacterias
lácticas. Tesis
doctoral. Farías, M.E. 1996.
Univ.
Nacional
de Tucumán ; b) McAuliffe
O, Ross RP, Hill C.
Lantibiotics:
structure, biosynthesis and mode of action
FEMS Microbiol Rev May;25(3):285-308,
2001
5
Nisin preparation: Affirmation of GRAS status as a direct human food
ingredient. Food and Drug Admin., FDA. 1988
[vi]
O'Sullivan L, Ross RP, Hill C.
Potential of bacteriocin-producing lactic acid bacteria for
improvements in food safety and quality. Biochimie,
84(5-6):593-604, 2002
[vii]
Grushina VA, Baranova IP, Egorov NS. Prikl
Dynamics
of nisin accumulation in a culture of Streptococcus lactis. Biokhim.Mikrobiol,15(3):472-4,
1979
[viii]
Abee
T., Krockel L., Hill C.. Bacteriocins:
modes of action and potentials in food preservation and control of
food
poisoning.
Int. J. Food Microbiol. 28, 169-185, 1995
[ix]
Gao,
F.H., Abee T.L. y Koonings W.N.. Mechanism of action of the peptide
antibiotic nisin in liposome and
cytochrome
C oxidase containing proteoliposomes. Appl.
Environ. Microbiol.,
57: 2164-2170, 1991
[x]
Garcerá,
M.J., Elfernik, M.L., Driessen, A.J. and Koonings, W.N. In vitro
pore forming ability of lantibiotic nisin
role
of proton motive force and lipid composition. Eur.
J. Biochem.,
212: 417-422, 1993
[xi]
Hechard
Y, Sahl HG.
Mode of action of modified and unmodified bacteriocins from
Gram-positive bacteria.
Biochimie
84(5-6):545-57, 2002; a)
Wiedemann
I, Breukink E, van Kraaij C, Kuipers OP, Bierbaum G, de Kruijff B,
Sahl HG. Specific
binding of nisin to the peptidoglycan precursor lipid II combines
pore formation and inhibition of cell wall biosynthesis for potent
antibiotic activity. J
Biol Chem
19;276(3):1772-9, 2001
[xiii]
Scott A., Schillinger
U, Becker B, Vignolo G, Holzapfel WH.
Efficacy of nisin in combination with protective cultures against
Listeria monocytogenes in tofu.
Int
J Food Microbiol
30;71(2-3):159-68, 2001; a) Elotmani F, Revol-Junelles
AM, Assobhei O, Milliere JB. Characterization of anti-Listeria
monocytogenes bacteriocins from Enterococcus faecalis, Enterococcus
faecium, and Lactococcus lactis strains isolated from Raib, a
Moroccan traditional fermented milk Curr Microbiol
;44(1):10-7 2002; b)
www.foodhaccp.com/internetjournal/IJFSv1-2.pdf;
c) Davies EA,
Bevis HE, Delves-Broughton J. The use of the bacteriocin,
nisin, as a preservative in ricotta-type cheeses to control the
food-borne pathogen Listeria monocytogenes. Lett Appl Microbiol
24(5):343-6, 1997; d)
Rodriguez E, Arques JL, Gaya P, Nunez M, Medina M.
Control of Listeria monocytogenes by bacteriocins and
monitoring of bacteriocin-producing lactic acid bacteria by colony
hybridization in semi-hard raw milk cheese. J Dairy Res Feb;
68(1):131-7, 2001
[xiv]
Inhibition
of Salmonella on poultry skin using protein- and
polysaccharide-based films containing a nisin formulation.
Natrajan N, Sheldon BW. J Food Prot
Sep; 63(9):1268-, 2000
[xv]
Szabo
EA, Cahill ME.
Nisin and ALTA 2341 inhibit the growth of Listeria monocytogenes on
smoked salmon packaged under vacuum or 100% CO2.
Lett Appl Microbiol 28(5):373-7, 1999
a) www.kyoto-story.ne.jp/.../hukusimakatuo/
shouhin-12.htm
[xvi]
Thomas LV,
Ingram RE, Bevis HE, Davies EA, Milne CF, Delves-Broughton J. Effective
use of nisin to control Bacillus and Clostridium spoilage of a
pasteurized mashed potato product.
J Food Prot 65(10):1580-5,
2002
[xvii]
Brumfitt
W, Salton MR, Hamilton-Miller JM. Nisin, alone and combined with
peptidoglycan-modulating antibiotics: activity against
methicillin-resistant Staphylococcus aureus and vancomycin-resistant
enterococci. J Antimicrob Chemother, , 50(5): 731-4, 2002
[xviii]
Gill AO, Holley RA. Surface
application of lysozyme, nisin, and EDTA to inhibit spoilage and
pathogenic bacteria on ham and bologna.
J Food Prot 63(10):1338-46,
2000; a)
Hoffman
KL, Han IY, Dawson PL. Antimicrobial
effects of corn zein films impregnated with nisin, lauric acid, and
EDTA.
J Food Prot 64(6):885-9,
2001; b)
Dawson PL, Carl GD, Acton JC, Han IY. Effect
of lauric acid and nisin-impregnated soy-based films on the growth
of Listeria monocytogenes on turkey bologna.
Poult Sci 81(5):721-6,
2002 ; c) Coma V, Sebti I, Pardon P, Deschamps A,
Pichavant FH. Antimicrobial
edible packaging based on cellulosic ethers, fatty acids, and nisin
incorporation to inhibit Listeria innocua and Staphylococcus aureus.
J
Food Prot Apr 64(4):470-5, 2001; d) Growth
and Biocontrol of Enterotoxigenic Bacillus cereus in Infant
Formula
FRI News Letter, , Vol 11, N° 1, Spring 1999 Food research
Institute UW-Madison
[xix]
Progetto No: FAIR-CT96-1148 Coordinatore del progetto: Dr. E. J.
Smid, Agrotechnical Research Institute (ATO), Wageningen univiersity
Center, PO box 17, NL-6700 AA Wageningen, THE NETHERLANDS, Tel: 00
31 317 475000, Fax:0031317475347,e-mail:m.h.j.bennik@ato.dlo.nl
Divulgazione
a cura della Direzione Nazionale FFE, Dipartimento di Scienze degli
Alimenti, Università degli Studi di Udine - e-mail: ffe@dsa.uniud.it,
sito Internet: www.uniud.it/ffe/welcomeflair.htm
[xx]
Delves-Broughton,
J. Nisin and its uses as a food preservative. J. Food Technol.,
100-117, 1990
[xxi]
Cleveland J, Montville TJ, Nes IF, Chikindas ML.
Bacteriocins: safe, natural antimicrobials for food preservation.
Int J Food Microbiol 4;
71(1):1-20, 2001
[xxii]
Sears
PM, Smith BS, Stewart WK, Gonzalez RN, Rubino SD, Gusik SA, Kulisek
ES, Projan SJ, Blackburn P. J Evaluation
of a nisin-based germicidal formulation on teat skin of live cows. Dairy
Sci
75(11):3185-90, 1992
[xxiii]
Cooperative extension - Institute of agriculture
and natural resources. Department of Veterinary on Biomedical
sciences University of Nebraska-Lincoln, Volume 30, N 10, pag 5
[xxiv]
Howell TH, Fiorellini JP, Blackburn P, Projan SJ, de la Harpe J,
Williams RC.
The effect of a mouthrinse based on nisin, a bacteriocin, on
developing plaque and gingivitis in beagle dogs.
J Clin Periodontol
20(5):335-9, 1993
Scheda tecnica
Nome
dei prodotti : LFE-1000, LFE-8000, LFE-15000
Nome
INCI : Lactococcus Ferment Extract
|
Test
|
Standard
|
|
LFE-1000
|
LFE-8000
|
LFE-15000
|
|
Aspetto
|
Polvere
grigia o bianca
|
Polvere
grigia o bianca
|
Polvere
bianca o grigia
|
|
Identificazione
|
Conforme
|
Conforme
|
Conforme
|
|
Perdita
al essicamento
|
<
3%
|
<
3%
|
<
3%
|
|
GRANULOMETRIA
|
100%
passa gli 80 mesh
|
100%
passa gli 80 mesh
|
100%
passa gli 80 mesh
|
|
pH
(soluzione acquosa al 10%)
|
3,10~3,60
|
3,10~3,60
|
3,10~3,60
|
|
SULUBILITA
IN ACQUA
|
100%
a pH 5
80-90%
a pH 6,5-7,0
|
100%
a pH 5
80-90%
a pH 6,5-7,0
|
100%
a pH 5
80-90%
a pH 6,5-7,0
|
|
Pb
|
<
2 ppm
|
<
2 ppm
|
<
2 ppm
|
|
As
|
<
1 ppm
|
<
1 ppm
|
<
1 ppm
|
|
Zn
|
<25
ppm
|
<25
ppm
|
<25
ppm
|
|
Cu
|
<
50 ppm
|
<
50 ppm
|
<
50 ppm
|
|
Cu+Zn
|
<50
ppm
|
<50
ppm
|
<50
ppm
|
|
Potenza
in acqua
|
1.000
IU/mg
|
8.000~10.000
IU/mg
|
12.000~15.000
IU/mg
|
|
Conteggio
totale dei batteri
|
<1000
cfu/g min
|
<1000
cfu/g min
|
<1000
cfu/g min
|
|
Lieviti
e funghi
|
<100
cfu/g
|
<100
cfu/g
|
<100
cfu/g
|
|
E.Coli
|
Negativo
|
Negativo
|
Negativo
|
|
Salmonelle
|
Negativo
|
Negativo
|
|
Conservare
in luogo fresco e asciutto, non congelare, tenere protetto da luce e
calore
torna su
|
| |
|